Диагностика рака пищевода в ряде случаев сопряжена с большими трудностями. Поэтому весьма актуально пополнение арсенала диагностических методов для распознавания рака пищевода каким-либо достоверным и безопасным методом, каким и является цитологическое исследование.
Цитологические исследования, или, точнее, методы клинической цитологии, получили за последние десятилетия широкое распространение в диагностике злокачественных новообразований различной локализации.
В настоящее время опубликовано значительное количество работ с описанием методики взятия и исследования материала, а также с оценкой эффективности данного метода в диагностике рака пищевода.
Все описанные методы могут быть объединены в пять групп: 1) абразивные, 2) ирригационные, 3) аспирационные, 4) контактные и 5) применяемые при эзофагоскопии.
Абразивные методы. Получали для исследования материал из пищевода с помощью абразивного баллона, предложенного Panico и др. для диагностики рака желудка. «Абразивный желудочный зонд-баллон состоит из двух вставленных одна в другую трубок-зондов, абразивного баллона, резиновой груши для нагнетания воздуха и шприца для откачивания желудочного содержимого. Диаметр внутренней резиновой трубки 5 мм, диаметр наружной хлорвиниловой трубки 7 мм. Таким образом, между двумя трубками остается пространство, обеспечивающее свободное прохождение воздуха в баллон и обратно. К дистальному концу зонда прикреплена металлическая олива, способствующая лучшему прохождению зонда в антральный отдел желудка. На расстоянии 3 и 18 см проксимально от оливы внутри хлорвиниловой трубки находятся два металлических кольца.
Абразивный баллон изготовлен из тонкой резины; для придания шероховатости на наружную поверхность баллона наклеен слой резиновой стружки или на него надевается шелковая сеточка с 250 узелками.
Баллон прикреплен шелковой нитью к тем участкам зонда, где внутри находятся металлические кольца. Для прохождения в баллон воздуха в хлорвиниловой трубке между кольцами имеется несколько отверстий.
На расстоянии 90 см от оливы с помощью металлического перехода резиновая трубка выведена через стенку хлорвиниловой трубки. К свободному концу хлорвиниловой трубки посредством стеклянного перехода присоединяется резиновая груша. Резиновая трубка заканчивается металлической втулкой для присоединения шприца» (цит. по И. Т. Шевченко, 1962).
После введения натощак зонда и откачивания содержимого желудка зонд продвигают до пилоруса и, введя в баллон через грушу воздух, вытягивают зонд с таким расчетом, чтобы баллон достиг кардии. Эту процедуру повторяют 5 раз, сочетая ее с промыванием желудка физиологическим раствором и последующим отсасыванием его шприцем.
После извлечения зонда исследуют осадок промывных вод, полученный центрифугированием, и мелкие тканевые частицы, фиксировавшиеся на стенке баллона (рис. 39).
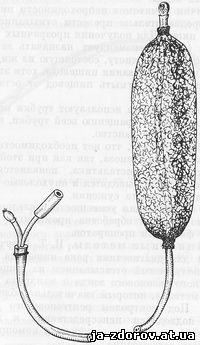
Рис. 39. Абразивный баллон.
Ирригационные методы. Некоторые врачи отрицательно относятся к абразивным методам получения материала, считая, что они значительно и неоправданно осложняют исследование; кроме того, морфологические особенности клеток, полученных непосредственно с места поражения, менее отчетливо выражены, чем у клеток, отторгшихся в результате естественной десквамации. Последнее обстоятельство является причиной неточных заключений, поэтому авторы отдают предпочтение ирригационным методам, при которых материалом для исследования служат промывные жидкости пищевода.
Исследование проводится натощак не ранее чем через 12 часов после приема пищи и через 48 часов после введения бария.
С помощью рентгенологического исследования устанавливается уровень расположения патологических изменений. В сидячем положении больному вводят трубку Левина № 20 на глубину 45 см. Больной выпивает 100 мл раствора Рингера или физиологического раствора, которые немедленно отсасывают, т. е, получается смыв со всей поверхности пищевода. Затем трубку постепенно вытягивают и каждые 5 см повторяют промывание 50 мл раствора Рингера. Особенно энергично промывают на уровне, где предполагается наличие патологического процесса. Если при аспирациях промывную жидкость получить обратно не удается, то всю процедуру проводят в лежачем положении. Промывные воды больного быстро центрифугируют и осадок исследуют под микроскопом.
Применяемые ирригации муколитическими веществами - папаином, лаурилсульфатом, соликонами и а-хемотрипсином, по мнению и др., не повышают процента обнаружения опухолевых клеток в промывных водах.
При наличии симптомов непроходимости пищевода необходимо предварительно провести отмывание пищевода от остатков пищи. Для получения прозрачных промывных вод рекомендуют назначать за несколько дней до исследования диету, состоящую из жидкой пищи, или ежедневные промывания пищевода, хотя это не всегда позволяет полностью отмыть пищевод от остатков пищи и слизи из бронхов.
При явлениях стеноза используют трубки меньшего диаметра и прибегают к вращению всей трубки, вводя ее конец в суженное пространство.
Рубин (1961) считает, что нет необходимости проводить трубку ниже уровня стеноза, так как при этой манипуляции усиливается перистальтика, появляется рвота и со рвотными массами выводятся и опухолевые клетки, накопившиеся ниже места сужения.
Большое значение для успешности исследования имеет максимально быстрая обработка промывных вод, приготовление и фиксация препаратов.
Аспирационные методы. И. Т. Шевченко (1949, 1952, 1957) для диагностики рака пищевода исследовал материал, полученный отсасыванием из пищевода с помощью тонкого резинового зонда и мандрена из мягкого, гнущегося металла, который значительно облегчал введение зонда. Под контролем рентгеновского экрана конец зонда подводился непосредственно к месту поражения и после удаления мандрена с помощью шприца производилось отсасывание.
Автор отмечал, что предлагаемый им метод безопасен, дает возможность в случае необходимости повторять исследование и не требует большого количества времени. Большим преимуществом метода является аспирация материала непосредственно у места расположения опухоли.
Кандарджис (1963) для прицельной аспирации пользовался зондом «Camus» или катетером с большим количеством отверстий на металлическом конце. Зонд или катетер под контролем рентгеновского экрана или эзофагоскопа подводился к месту поражения. Аспирация производилась шприцем емкостью 20 мл; через несколько секунд зонд или катетер извлекался из пищевода. Метод, по мнению автора, прост, безопасен, отнимает мало времени и позволяет получить достаточное количество материала для исследования.

Рис. 40. Зонд для аспирации из пищевода по Алексееву.
На 5 Всесоюзной конференции врачей-лаборантов в 1961 г. Н. Г. Алексеев сообщил о возможности взятия материала для исследования путем аспирации из пищевода через толстый резиновый зонд с помощью шприца Жане. Н. Г. Алексеев пользуется детским желудочным зондом, в стенке которого делают еще два отверстия так, чтобы все четыре отверстия располагались с четырех сторон зонда; на конце зонда наносят насечки (рис. 40).
Практическое использование рекомендаций Н. Г. Алексеева позволило оценить их как наиболее простой, безопасный и доступный в любых условиях способ получения материала из просвета пищевода.
Перед введением зонда заднюю стенку глотки анестезируют смазыванием 2% раствором дикаина, а проксимальный конец зонда соединяют со шприцем Жане. После введения зонда до уровня кардии поршень шприца оттягивают до деления 50 - 60 и зонд медленно извлекают из просвета пищевода. Благодаря отрицательному давлению в зонд через отверстия в его стенке аспирируется материал со всей поверхности пищевода.
Если зонд извлекается с трудом, то поршень шприца опускают ниже (т. е. уменьшают отрицательное давление в системе зонд - шприц) до тех пор, пока зонд не будет продвигаться без усилий. После извлечения зонд кладут в большую кювету и под давлением промывают 200 - 300 мл физиологического раствора. Для исследования из физиологического раствора отбирают все комочки кровянистой слизи и мелкие тканевые частицы.
Контактные методы. А. Я. Альтгаузен (1946) вводил толстый зонд в пищевод до места сужения; после извлечения зонда конец его споласкивался в чашке с водой. Все приставшие к концу зонда тканевые частицы отмывались водой и исследовались под микроскопом. А. Я. Альтгаузен выявлял мелкие клочки опухолевой ткани, позволявшие уточнять клинический диагноз. Полученные частицы ткани иногда были таких размеров, что давали возможность произвести гистологическое исследование.
Кандарджис с сотрудниками (1963) получали материал исследования другим способом. Полуригидный зонд обертывался стерильной ворсистой хлопчатобумажной тканью, укрепленной на зонде несколькими оборотами нитки и пропитанной стерильным физиологическим раствором, и вводился в пищевод.
Соприкосновение зонда с опухолью воспринимается в виде эластического сопротивления продвижению зонда, что преодолевают легким нажимом. Более или менее значительное усилие при этом абсолютно недопустимо, так как может привести к разрыву пищевода.
Когда зонд достигает места поражения, его оставляют в пищеводе примерно на час. После извлечения зонда на участке ткани, соприкасавшейся с опухолью, могут оставаться мелкие частицы опухолевой ткани, из которых приготовляют препараты для исследования.
Преимуществом этого метода является возможность прицельного взятия материала, недостатком - очень большое количество препаратов, которые врач должен просмотреть, а также длительность пребывания зонда в пищеводе.
Получение материала при эзофагоскопии. Н. Г. Алексеев (1955, 1960) исследовал мазки, приготовленные из кровянистых комочков, которые он снимал после эзофагоскопии с внутренней поверхности эзофагоскопа и с концов щипцов. Фиксация и окраска мазков производились по предложенному автором ускоренному методу.
Примечательно то, что у 10 из 14 больных раком пищевода в исследуемом материале были обнаружены опухолевые клетки и в 1 случае результаты исследования дали возможность высказать подозрение о наличии рака.
Милл (цит. по Таннер, 1961) в случаях, когда при эзофагоскопии не представляется возможным взять кусочки ткани для гистологического исследования, предложил пропускать через подозрительный участок тонкую резиновую трубку с оливой. После извлечения трубку и оливу обмывают физиологическим раствором. Для исследования берут осадок, полученный центрифугированием этого физиологического раствора.
Мессельт (1952) материал из пищевода для цитологического анализа брал во время эзофагоскопии с помощью ватных тампонов. Если при эзофагоскопии место поражения находится вне поля зрения, автор считает возможным стержень с ватным тампоном продвинуть за пределы видимости. Из полученного на ватном тампоне материала немедленно делаются мазки на предметных стеклах.
В клинической цитологии применяются различные методы подготовки и обработки материала для микроскопического исследования. Наиболее простым является метод нативного препарата. Он подробно разработан С. Л. Эрлихом и А. Я. Альтгаузеном и опубликован в многочисленных работах, посвященных цитологической диагностике новообразований в различных экскретах и секретах организма.
Метод заключается в том, что комочек исследуемого материала помещают на предметное стекло и накрывают покровным без предварительной обработки.
Отбор материала для микроскопии проводят с помощью макроскопического послойного исследования, заключающегося в том, что жидкие секреты, экскреты, промывные воды последовательно выливают небольшими порциями в чашку Петри и рассматривают в тонком слое. Материал, имеющий густую консистенцию, растягивают тонким слоем и также тщательно просматривают.
Целью этого макроскопического исследования является обнаружение мельчайших тканевых частиц, отбор и приготовление из них нативных препаратов для просмотра под микроскопом. Тканевые частицы при осмотре материала невооруженным глазом отличаются от общего фона своей консистенцией, формой и цветом; они сероватые, желтоватые, иногда кровянистые, более плотные, чем окружающая среда, и потому не растягиваются при расправлении их препаровальными иглами. Нередко эти кусочки ткани бывают так мелки, что для обнаружения их приходится прибегать к лупе. Наконец, они могут быть так малы, что отыскать их удается только при микроскопическом исследовании. Поэтому, если при осмотре материала выявить тканевые частицы не удается, приготовляют серию нативных препаратов из любого исследуемого материала (осадок мочи, содержимое желудка, мокрота и т. п.) и затем изучают их под микроскопом.
Значительным преимуществом нативного препарата является то, что при его приготовлении хорошо сохраняются клеточные комплексы.
В настоящее время более распространено исследование окрашенных препаратов. Для этого из исследуемого материала готовят тонкие мазки, которые фиксируют и окрашивают одним из многочисленных существующих методов. Чаще всего окрашивают по Паппенгейму или Романовскому - Гимзе, т. е. методами, применяемыми для окраски мазков крови. При этих методах цитоплазма клеток окрашивается в различной интенсивности голубой, синий, розовый или фиолетовый цвет. Хорошо видна зернистость в цитоплазме и детальная структура ядер, которые окрашиваются в темно-фиолетовый или темно-лиловый цвет.
Демонстративные препараты получаются также при окраске по Папаниколау. В препаратах, обработанных по его Мегодике, ядра клеток красятся в сине-фиолетовый цвет, оксифильная цитоплазма - в розовый, базофильная - в сине-зеленый цвет. Эритроциты окрашиваются в коричневый, а лейкоциты - в бледно-красный цвет с желто-синими ядрами.
В нативных и окрашенных препаратах, приготовленных из материала, полученного из пищевода, можно обнаружить лейкоциты, клетки эпителия, выстилающего пищевод, эритроциты, особенно многочисленные при аспирации, детрит и, наконец, при явлениях застоя - остатки пищи.
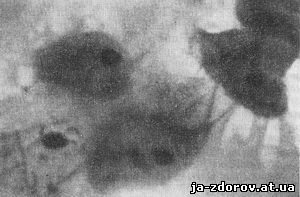
Рис. 41. Микрофото. Плоский эпителий. Окрашенный препарат. Ув. 500.
Обрывки слизистой оболочки пищевода выглядят в виде пластов клеток плоского эпителия с широкой протоплазмой и мелкими круглыми ядрами (рис. 41). Иногда в этих пластах встречаются слоистые округлые скопления эпителиальных клеток, так называемые луковицы (рис. 42); они состоят из нормальных клеток и отличаются этим от таких же образований, встречающихся при плоскоклеточном раке, но состоящих из атипичных клеток.
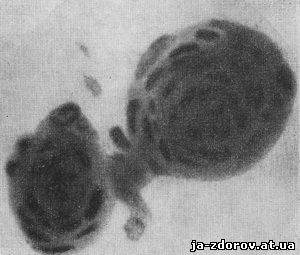
Рис. 42. Микрофото. Луковица из клеток нормального плоского эпителия. Окрашенный препарат. Ув. 500.
В препаратах могут встречаться клетки из более глубоких слоев плоского эпителия, например парабазальные, которые отличаются меньшими размерами, округлой формой и относительно более крупным ядром. Цитоплазма этих клеток, как правило, базофильная, т. е. после окраски по Паппенгейму и Романовскому - Гимзе она становится голубой или светло-синей.
Частицы слизистой оболочки, аспирированной из двух дистальных сегментов пищевода, могут состоять из цилиндрического эпителия, выстилающего иногда этот отрезок пищевода.
При застое пищи в препаратах имеются капли жира, клетчатка, в некоторых случаях много трихомонад.
Клочки некротизированной ткани состоят из скоплений мелкозернистого детрита.
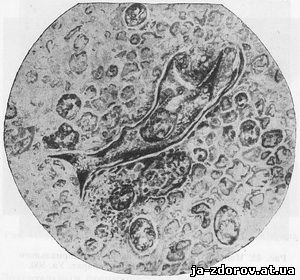
Рис. 43. Микрофото. Уродливая крупная опухолевая клетка при плоскоклеточном раке с ороговением. Клетка по своим очертаниям напоминает рыбу. Нативный препарат. Ув. 400.
При злокачественных новообразованиях пищевода удается обнаружить элементы опухоли в виде отдельных бластоматозных клеток и их комплексов.
Биологические особенности бластоматозных клеток, а именно их тенденция к беспредельному росту с большей или меньшей потерей способности к дифференцировке, находят свое отражение в морфологической структуре клеток опухолей, отличающейся от клеток нормальной ткани.
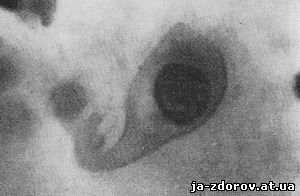
Рис. 44. Микрофото. Плоскоклеточный рак с ороговением. Клетка в форме головастика. Окрашенный препарат. Ув. 1140.
К морфологическим особенностям опухолевых клеток относятся:
1. Полиморфизм клеток (т. е. различные формы опухолевых клеток), особенно резко выраженный при плоскоклеточном раке с ороговением, когда клетки иногда имеют причудливые очертания, напоминающие рыб (рис. 43), головастиков (рис. 44), змей (рис. 45), теннисную ракетку (рис. 46) и др.
2. Анизоцитоз, т. е. значительные колебания размеров клеток.
3. Увеличение объема ядра, в результате чего ядерно-цитоплазматическое соотношение сдвигается в сторону ядра, а иногда ядро занимает большую площадь клетки, чем цитоплазма (рис. 47).
4. Гиперхромия ядер, неравномерное распределение в них хроматина, неправильные контуры ядер.
5. Многочисленные мелкие ядрышки или одно крупное.
6. Наличие синцитиальных образований.
7. Обилие фигур деления, особенно патологических.
8. Распространенные дистрофические изменения.
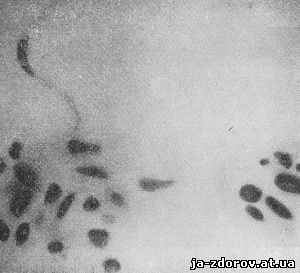
Рис. 45. Микрофото. Плоскоклеточный рак с ороговением. Клетка змеевидной, вытянутой формы. Окрашенный препарат. Ув. 500.
Все перечисленные признаки, обнаруженные в отдельности, не являются строго специфичными только для опухолевых клеток. Они могут встречаться и при других процессах, сопровождающихся интенсивным размножением клеток, например при регенерации, метаплазии и др. Поэтому распознавание опухолевых клеток основывается на обнаружении не одного из перечисленных признаков, а совокупности всех морфологических особенностей клеток, т. е. на выявлении их атипии.
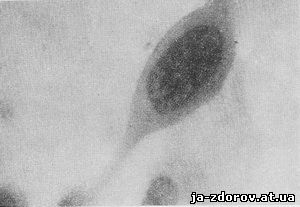
Рис. 46. Микрофото. Плоскоклеточный рак с ороговением. Клетка в форме теннисной ракетки. Окрашенный препарат, Ув. 1140.
Естественно, что обнаружение комплексов атипичных клеток, т. е, мельчайших кусочков опухолевой ткани, значительно повышает уверенность в правильности определения бластоматозного процесса.
Беспорядочность расположения клеток в комплексе и перечисленные выше морфологические их особенности в сочетании с дистрофическими изменениями придают всему комплексу пестрый, «неспокойный» вид, отличающий мельчайшие частицы опухоли от монотонной картины строения нормальной ткани.
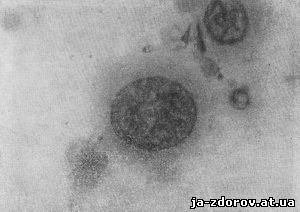
Рис. 47. Микрофото. Раковая клетка с выраженным нарушением ядерно-цитоплазматического отношения. Окрашенный препарат. Ув. 900.
Заметим, что характер расположения клеток в комплексе и морфология отдельных элементов позволяют определить не только бластоматозный процесс, но подчас и гистологическую структуру опухоли.
Плоскоклеточный рак с ороговением характеризуется выраженным полиморфизмом клеток, явлениями ороговения цитоплазмы при сравнительно большом ядре. Клетки ороговевающего плоскоклеточного рака часто дают характерные сочетания в виде луковиц, стержней и жемчужин. Последние представляют собой круглые или овальные гомогенные образования с характерным перламутровым блеском. Элементы плоскоклеточного рака с ороговением в окрашенном препарате выглядят значительно менее убедительно, чем в нативном. Луковицы, стержни и жемчужины из ороговелых клеток окрашиваются по Паппенгейму очень бледно, а ядра иногда вообще не бывают видны. Эта форма рака легче распознается в нативном препарате, особенно при распадающемся раке, когда в массе детрита перечисленные элементы (стержни, жемчужины) являются единственным доказательством наличия опухоли (рис. 48).
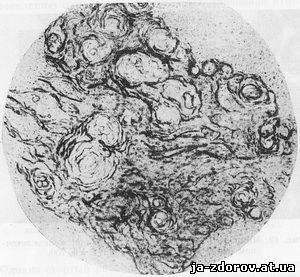
Рис. 48. Микрофото. Скопления раковых жемчужин в некротическом клочке опухолевой ткани. Нативный препарат А. Я. Альтгаузена. Ув. 140.
При неороговевающем плоскоклеточном раке размеры клеток варьируют, относительно крупные ядра располагаются преимущественно в центре клеток, которые до некоторой степени сохраняют сходство с клетками нормального плоского эпителия. Частицы недифференцированного мелкоклеточного рака состоят из скоплений небольших клеток.
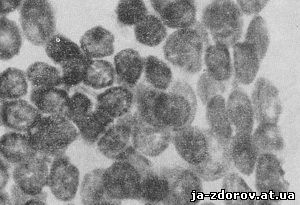
Рис. 49. Микрофото. Клеточный комплекс при мелкоклеточном раке. Окрашенный препарат. Ув. 700.
Распознавание мелкоклеточного рака в нативном препарате иногда бывает сопряжено с большими трудностями. Обычно приходится прибегать к изучению окрашенных мазков, в которых элементы недифференцированного мелкоклеточного рака представлены комплексами мелких клеток (рис. 49, 50) с относительно большими ядрами.
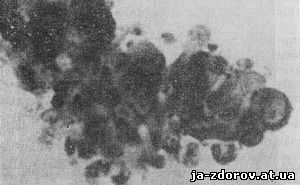
Рис. 50. Микрофото. Клеточный комплекс при мелкоклеточном раке. Окрашенный препарат. Ув. 540.
Часто в ядрах бывают крупные нуклеолы. Структура ядра разнообразна, иногда хроматин в ядре может распределяться в форме глыбок или более или менее равномерно: цитоплазма в виде узкого пояска окружает ядро, в ней мелкие вакуоли. При этой форме рака чаще встречаются фигуры митозов.
Расположение клеток в комплексе, как правило, беспорядочное. Крупные комплексы окрашиваются плохо; только клетки, расположенные по периферии, окрашиваются хорошо и структура их отчетливо видна. В центре крупного комплекса цитоплазма и ядра клеток окрашиваются в бледно-синий цвет (при окраске по Паппенгейму), но отчетливо выступает обилие темно-синих ядрышек.
Аденокарцинома характеризуется округлыми комплексами, напоминающими железистые структуры. Иногда комплексы вытянуты и похожи по внешнему виду на гусениц. Размеры опухолевых клеток при аденокарциноме различные: встречаются очень крупные экземпляры, а иногда опухоль состоит из мелких клеток, которые по своей величине не отличаются от нормального цилиндрического или кубического эпителия.
Характерно для клеток аденокарциномы эксцентрическое расположение ядра (Н. Н. Шиллер-Волкова и др., 1964), отодвинутое к периферии при сохранении клетками секретирующей функции.
При некоторых патологических состояниях в результате дистрофических изменений и репаративных процессов в материале, полученном из пищевода, могут выявляться отдельные клетки с некоторыми признаками атипии. Дифференцирование таких клеток с опухолевыми бывает трудной задачей. Именно эти клетки могут быть причиной ложного заключения о наличии злокачественного новообразования.
К клеткам-«симулянтам» Рубин (1961) относит молодые фибробласты из грануляционной ткани, пролиферирующие клетки базального слоя плоского эпителия. По Грахам (1954), правильное расположение хроматина в этих клетках позволяет отличить их от опухолевых.
Дистрофические изменения в клетках нормального эпителия могут привести к увеличению объема ядра и нарушению ядерно-цитоплазматического соотношения, т. е. к появлению одного из кардинальных признаков атипии.
Однако стертый рисунок ядра, прерывистая мембрана и вакуолизация цитоплазмы позволяют отличить дистрофически измененные клетки нормального эпителия от опухолевых.
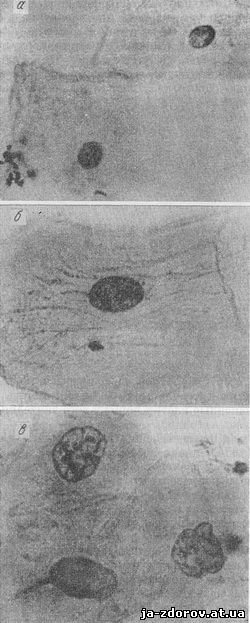
Рис. 51. Клетки плоского эпителия при макроцитозе.
а - нормальный плоский эпителий Окрашенный препарат; б - крупная клетка плоского эпителия. Окрашенный препарат; в - крупные клетки плоского эпителия с неравномерным распределением хроматина в ядрах. Окрашенный препарат. Ув. 900.
При В12- и фолиеводефицитных анемиях, как отмечает Грахам (1954), имеет место макроцитоз, т. е. появление клеток крупных размеров с большими бледно окрашенными ядрами и неправильным расположением в них хроматина (рис. 51, а, б, в). Дифференцировка этих клеток с опухолевыми также бывает связана с трудностями. Во избежание ошибки в трактовке происхождения этих клеток цитолог должен быть знаком с клиникой заболевания данного больного и результатами других методов комплексного исследования.
Если имеется подозрение на рак пищевода у больного с В12-дефицитной анемией, а цитологическое исследование не уточняет характера описанных выше макроцитарных клеток, Рубин (1961) рекомендует повторить исследование после курса терапии витамином В12.
Макроцитоз наблюдается и при воспалительных процессах, и при застое пищевых масс выше места сужения, а при раке - одновременно с опухолевыми клетками.
При стриктуре, не связанной с бластоматозным процессом, эти клетки могут дезориентировать исследователя при оценке характера патологического процесса. Основным отличием клеток при макроцитозе от опухолевых является, по Рубин (1961), сохранение у первых нормального ядерно-цитоплазматического соотношения.
В общем цитологическая диагностика рака пищевода относительно проста по сравнению с цитологической диагностикой злокачественных опухолей других локализаций. Однако перечисленные выше возможные источники ложных заключений требуют особого внимания при наличии в препаратах только отдельных изолированных клеток с атипией.
Сопоставление результатов цитологического исследования при раке пищевода свидетельствует о резком колебании процента положительных результатов у различных авторов (табл. 8).
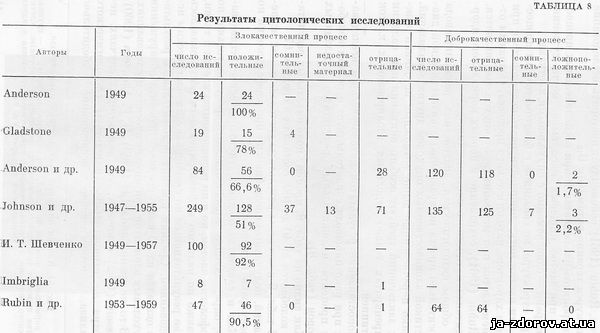
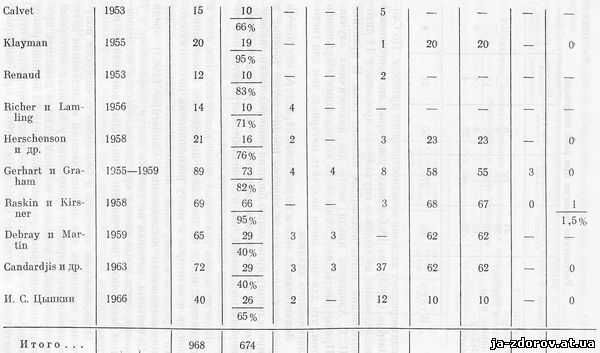
Как видно из табл. 8, процент положительных результатов колеблется от 40 до 100, составляя в среднем 67.
В табл. 9 приведены результаты гистологических исследований, полученные после биопсии при эзофагоскопии по поводу рака пищевода.
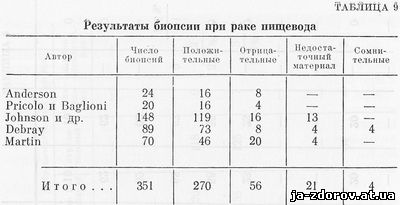
Как и следовало ожидать, гистологическое исследование, определяющее злокачественный рост не только по морфологии клеток, но и по расположению клеток в ткани, а также по наличию инфильтрирующего роста оказалось более результативным по сравнению с цитологическим исследованием. Средний процент положительных результатов оказался на 10 выше среднего процента обнаружения опухолевых элементов при цитологических исследованиях.
В то же время Кандарджис (1963), Н. Г. Алексеев (1960), Мессельт (1952) отмечают, что в некоторых случаях, несмотря на отрицательные результаты гистологического анализа, цитологическое исследование убедительно подтверждает наличие злокачественного процесса. По Кандарджис (1963), из 18 больных, у которых гистологическое исследование не выявило опухолевого процесса, у 11 цитологический метод подтвердил наличие рака. В практике Н. Г. Алексеева имели место два аналогичных случая. Преимущество цитологического исследования обусловлено тем, что для него легче получить материал, чем для гистологического анализа.
Значительный отек и выраженная стриктура над местом расположения опухоли нередко препятствуют точному и прицельному проведению биопсии непосредственно из опухоли; для исследования захватываются кусочки соседних нормальных тканей, чем и объясняются отрицательные гистологические данные в этих случаях.
В то же время указанные выше изменения, как отек и стриктура, могут не помешать подведению более тонких зондов и катетеров к месту расположения патологического процесса и получению полноценного материала для цитологического исследования. Кандарджис (1963) среди 13 больных, которым не удалось ввести эзофагоскоп, у 7 нашел опухолевые клетки при цитологическом исследовании материала, полученного с помощью контактного метода.
Относительная простота и безопасность способов получения материала для цитологического исследования дают возможность широкого применения у больных повторных исследований, с помощью которых удается повысить процент положительных результатов. Среди 25 больных раком пищевода, у которых однократное исследование дало отрицательный результат, Кандарджис (1963) при повторном взятии материала обнаружил опухолевые клетки у 19 человек.
Эффективность цитологического исследования в значительной мере зависит от локализации опухоли в пищеводе (табл. 10).
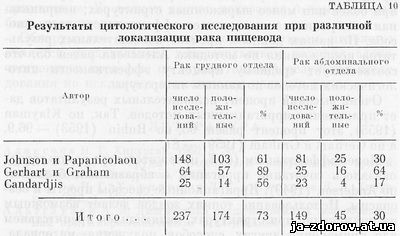
Как видно из табл, 10, цитологическое исследование наиболее эффективно при расположении ракового процесса в средней трети пищевода.
Меньший процент положительных результатов при раковых опухолях абдоминальной части пищевода и кардиального отдела желудка, распространяющихся на пищевод, очевидно, обусловлен большими трудностями получения материала для исследования. Эффективность цитологической диагностики при раке пищевода зависит до известной степени и от методики получения этого материала.
Каждый из описанных выше методов имеет свои преимущества и недостатки. Очень хорошие результаты получены И. Т. Шевченко (1957) с помощью прицельной аспирации непосредственно с места расположения опухоли. Из 100 больных раком пищевода при цитологическом исследовании элементы злокачественного образования были обнаружены у 92%.
К преимуществам аспирационных методов должны быть отнесены быстрота, простота и большое количество клеток, которое при этом удается получить.
Однако, как справедливо отмечает Н. Г. Алексеев (1965), метод И. Т. Шевченко не может считаться абсолютно безопасным вследствие необходимости применения металлического мандрена при введении зонда.
Аспирационное исследование по методике Алексеева (1965) просто и абсолютно безопасно, однако толстый зонд, предложенный автором для аспирации, нельзя применять при более или менее выраженных стриктурах; неприцельная аспирация также снижает эффективность этого способа. По нашим данным, процент положительных результатов исследования по методике Алексеева равен 65, что соответствует среднему проценту эффективности цитологических методов по данным литературы.
Очень высокий процент положительных результатов дает применение ирригационных методов. Так, по Кляйман (1955), этот процент равен 95, по Рубин (1953) - 96,9, а по Герхарт и Грахам (1959) - 81.
Менее эффективным (66% положительных результатов) оказалось сочетание ирригации с абразивным баллоном по Андерсон (1949). Ирригационные способы просты и безопасны. Использование тонких зондов делает возможным их применение при стриктурах, являющихся препятствием для применения других способов получения материала. Однако сама процедура более длительна по сравнению с аспирацией и поэтому более тягостна для больного. Последнее замечание относится и к контактному методу по Кандарджис и др., при котором катетер или зонд с тампоном оставляют в пищеводе на час.
Большое значение для эффективности цитологической диагностики, как справедливо отмечает Кандарджис, имеет не столько выбор способа получения материала из пищевода, сколько техника манипуляции и тщательность исследования.
Цитологическая диагностика рака пищевода характеризуется высокой достоверностью, которая определяется низким процентом ложноположительных ответов. Из табл. 8 видно, что процент этот очень невелик: так, у Андерсон и др. (1949) 1,7 ложноположительных результатов у Джонсон и др. (1955) - 2,2, у ВРаскин и Кирснер (1958) - 1,5.
По сводным данным литературы, на 622 исследования контрольной группы больных с нераковыми поражениями пищевода было только 6 ложноположительных заключений, что составляет около 1% всех случаев. Такой низкий процент обусловлен тем, что при различных патологических процессах в пищеводе клетки, симулирующие опухолевые элементы, встречаются реже, чем при новообразованиях другой локализации.
Цитологическое исследование как более простое и безопасное, переносимое больным легче, чем эзофагоскопия, по нашему мнению, может и должно найти более широкое применение. Во всяком случае показания к нему должны быть расширены.
Обнаружение опухолевых клеток опытным цитологом является убедительным доказательством наличия злокачественного процесса, но отрицательный результат исследования не исключает возможности наличия рака.















